Общая и органическая химия
Подтвержденная экспериментально в 1927 г. двойственная природа электрона, обладающего свойствами не только частицы, но и волны, побудила ученых к созданию новой теории строения атома, учитывающей оба этих свойства. Современная теория строения атома опирается на квантовую механику. Двойственность свойств электрона проявляется в том, что он, с одной стороны, обладает свойствами частицы (имеет определенную массу покоя), а …
Французские ученые П. Дюлонг и А. Пти установили закон, согласно которому атомная теплоемкость простого вещества в твердом состоянии (т. е. произведение его удельной теплоемкости на молярную массу атомов) есть величина постоянная и равная в среднем 26 Дж/ (К(моль). Из закона Дюлонга и Пти следует, что, разделив 26 на удельную теплоемкость простого вещества, легко определяемую экспериментально, …
В связи с этим электрон представляют не в виде материальной точки, а как бы "размазанным" по всему объему атома в виде так называемого электронного облака, имеющего области сгущения и разрежения электрического заряда. Представление об электроне, как о некотором облаке электрического заряда удобно; оно довольно точно передает особенности поведения электрона. Однако следует иметь в виду, что …
Для обозначения состава молекул простых и сложных веществ пользуются химическими формулами. Все молекулы данного вещества одинаковы, поэтому химическая формула выражает состав не только отдельной молекулы, но и всего химического соединения. Химическая формула вещества показывает, из каких элементов состоит данное вещество и сколько атомов каждого элемента входит в состав его молекулы. Химическая формула позволяет вычислить молекулярную …
По современным представлениям состояние электрона в атоме описывается 4 квантовыми числами. Главное квантовое число n характеризует величину энергии электрона и может принимать только положительные целочисленные значения: 1, 2, 3 и т. д. С увеличением главного квантового числа энергия электрона возрастает. Состояние электрона, отвечающее определенному значению главного квантового числа, называют энергетическим уровнем электрона в атоме. Помимо …
Для нахождения истинной химической формулы соединения необходимо знать его молекулярную массу. По условию задачи плотность углеводорода по водороду равна 43. Следовательно, его молекулярная масса согласно уравнению М = 2 * DH будет равна 2 * 43 = 86. Найденная величина вдвое превышает молекулярную массу, отвечающую простейшей формуле C3H7, следовательно, истинная формула искомого углеводорода C6H14. Часто …
Электроны, характеризующиеся одним и тем же квантовым числом, имеют электронные облака приблизительно одинаковых размеров. Поэтому говорят о существовании в атоме электронных слоев. Электронные слои обозначают большими буквами латинского алфавита K, L, M, N, O, причем K-слой является первым от ядра атома, ему соответствует главное квантовое число n = 1, L-слой — вторым, M-слой — третьим …
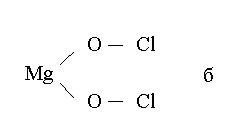
При графическом изображении молекул кислородсодержащих кислот необходимо помнить, что атомы водорода, способные замещаться металлом, всегда соединяются с кислотообразующим элементом через атом кислорода: В молекулах оснований гидроксильная группа (ОН)- всегда присоединяется к атому металла посредством атома кислорода: Ниже приведены графические формулы сульфата железа (III) Fe2(SO4)3 (а), гипохлорита магния Mg(OCl)2 (б). Следует однако иметь в …
Из квантово-механической теории следует, что с увеличением главного квантового числа (n) изменяются число и характер электронных орбиталей в пределах данного электронного слоя. Количество орбиталей для каждого значения (n) равно квадрату главного квантового числа (n2). Второе квантовое число l, описывающее форму электронного облака, называется орбитальным квантовым числом. При данном главном квантовом числе (n) орбитальное квантовое число …
Структурные формулы, изображая порядок соединения атомов в молекуле, не отражают однако их действительного пространственного расположения. С помощью пространственных моделей можно наглядно представить связи между атомами и их взаимное расположение. Шаро-стержневые модели молекул делают наглядным относительное положение атомов в пространстве, но не соответствуют действительному соотношению атомных радиусов и длине химических связей. Масштабные пространственные модели молекул, сделанные …





